想象一下,你大脑中那些被认为是阿尔茨海默病 “罪魁祸首” 的蛋白质,可能在数万年前曾是保护你的 “抗病毒英雄”。这听起来像是一场基因的 “时空错位”,却正是哈佛医学院附属麻省总医院研究团队最新发现的核心。目前,全球有超过 5500 万人患有阿尔茨海默病,这一数字预计到 2050 年将翻三倍。
长期以来,人们将大脑中出现的淀粉样斑块和 tau 蛋白缠结视为纯粹的有害产物,但近日发表在《Nature Neuroscience》上题为 “Phosphorylated tau exhibits antimicrobial activity capable of neutralizing herpes simplex virus 1 infectivity in human neurons” 的研究报告,却为这些 “病理特征” 赋予了前所未有的防御色彩:它们可能源自大脑为对抗感染而演化出的 “先天免疫防御系统”。

从“致病元凶”到“抗病毒卫士”:tau蛋白的双面人生
tau 蛋白本是神经元中协助微管稳定、保障轴突运输的 “好公民”,但当它被过度磷酸化后,就会脱离微管、聚集形成神经原纤维缠结——这是阿尔茨海默病的核心病理标志。
“作为遗传学家,我一直困惑:为什么人类会演化出易患阿尔茨海默病的基因突变?” 研究者 Rudolph Tanzi 博士坦言,这份疑惑驱动了整个研究。
为找到答案,团队利用人源神经元模型开展实验,将其暴露于单纯疱疹病毒 1 型(HSV-1)中——这种病毒已被多项研究证实与阿尔茨海默病风险相关。
结果令人震惊:HSV-1 感染会快速触发 tau 蛋白过度磷酸化,形成类似阿尔茨海默病的聚集物;而这些磷酸化 tau(p-tau)能直接绑定病毒衣壳上的 VP21/22a 和 VP16 蛋白,像 “手铐” 一样锁住病毒,显著中和其感染力,1.25μg/ml 的浓度就能有效抑制病毒斑块形成和扩散。更关键的是,感染后的神经元会释放 p-tau,这些蛋白不仅能在细胞内形成缠结 “困住” 病毒,还能被相邻未感染神经元吸收,启动防御准备,形成 “抗病毒预警网络”。
不仅如此,这套 “防御系统” 的运作机制远比想象中精密!研究发现,tau 蛋白的抗病毒活性高度依赖两个关键条件:
一是磷酸化修饰——非磷酸化的 tau 蛋白对 HSV-1 毫无抑制作用,而加入 GSK-3β 激酶抑制剂阻断 tau 磷酸化后,病毒感染率会显著上升;
二是蛋白结构——含有 4 个微管结合域的 2N4R 型 tau,磷酸化后对病毒的结合能力远强于其他异构体。
更有趣的是,p-tau 的防御作用还需要干扰素-γ(IFNγ)的协同:IFNγ 虽不直接抗病毒,却能增强 p-tau 的中和效果,而阻断 IFNγ 会让 p-tau 的保护作用失效。在包含神经元、星形胶质细胞和小胶质细胞的三维脑模型中,研究人员还观察到小胶质细胞会吞噬结合了 p-tau 的 HSV-1 病毒,进一步清除感染源,形成 “捕获-清除” 的防御闭环。
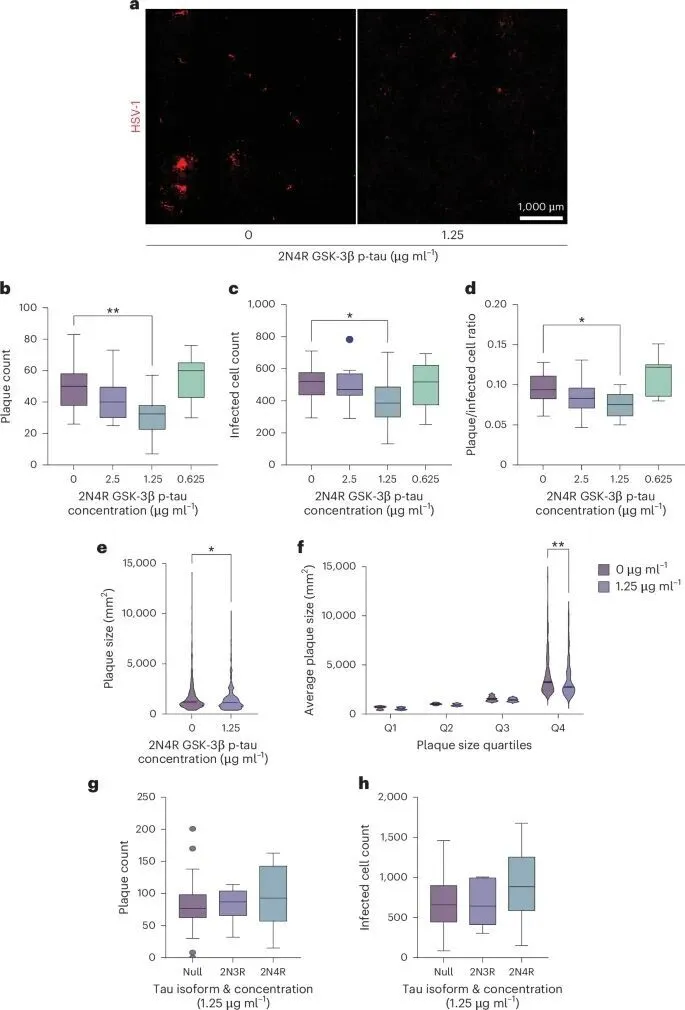
在二维人类神经元细胞培养中,tau蛋白的磷酸化对于抑制HSV-1感染及病毒空斑形成至关重要
这一发现与团队早期研究形成完美呼应:他们此前已证实,阿尔茨海默病的另一病理标志——淀粉样 β 蛋白(Aβ)是能捕获细菌、真菌和病毒的抗菌肽。如今 tau 蛋白的抗病毒功能被揭示,两者共同指向一个更宏大的图景:Aβ 斑块负责在细胞外 “拦截” 病原体,p-tau 缠结负责在细胞内 “中和” 漏网之鱼,再加上神经炎症的辅助,三者共同构成大脑应对感染的 “三重防御体系”。阿尔茨海默病的神经病理学特征,或许正是这套防御系统在演化中形成的有序先天免疫反应。
那么,这套 “英雄防御” 为何会演变成 “自身攻击”?
研究团队提出了大胆的演化假说:在人类平均寿命仅 30 岁左右的远古时代,Aβ 斑块和 p-tau 缠结的形成是短期、有效的应急防御,帮助人类在感染肆虐的环境中存活至繁殖年龄。但随着现代医学延长了人类寿命,这套本应 “临时启动” 的防御系统失去了调控,持续激活导致 p-tau 过度聚集、微管稳定被破坏,最终引发神经元损伤和认知衰退。
简单说,阿尔茨海默病可能不是一场 “蛋白质叛乱”,而是一场 “防御过载”——曾经保护祖先的机制,在现代长寿社会中 “过度服役”,最终反噬自身。
值得注意的是,研究虽聚焦于 HSV-1,但 p-tau 的抗病毒潜力可能不止于此。tau 蛋白的微管结合域中含有潜在的广谱抗菌序列,未来或许能发现其对其他与阿尔茨海默病相关的病原体(如牙龈卟啉单胞菌、巨细胞病毒)也有抑制作用。
当然,从实验室发现到临床应用仍有挑战:如何精准调控 p-tau 的磷酸化水平,让其发挥防御作用而不形成致病缠结?如何区分 “保护性缠结” 和 “致病性缠结”?这些问题仍需进一步探索。
但无论如何,这项研究彻底改写了我们对阿尔茨海默病的认知——那些被视为 “病理垃圾” 的蛋白聚集物,实则是演化留下的 “远古防御工事”。正如 Tanzi 博士总结的:“我们不应再简单地将 Aβ 和 tau 视为‘敌人’,而要理解它们的防御本质。未来的治疗方向或许不是‘镇压’,而是帮助这些‘老卫士’恢复平衡,让它们在对抗感染的同时,不再伤害自身神经元。” 对于数千万阿尔茨海默病患者而言,这束从演化深处照进的光芒,正为开发更智慧、更精准的治疗方案点亮了新方向。