近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。诺和诺德(Novo Nordisk)宣布多款多肽疗法的积极新进展:每日一次25 mg司美格鲁肽口服片剂(Wegovy)获美国FDA批准;司美格鲁肽注射液的心血管适应症上市申请获得中国国家药品监督管理局(NMPA)批准;NMPA正式批准长效生长激素注射液帕西生长激素的上市申请。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
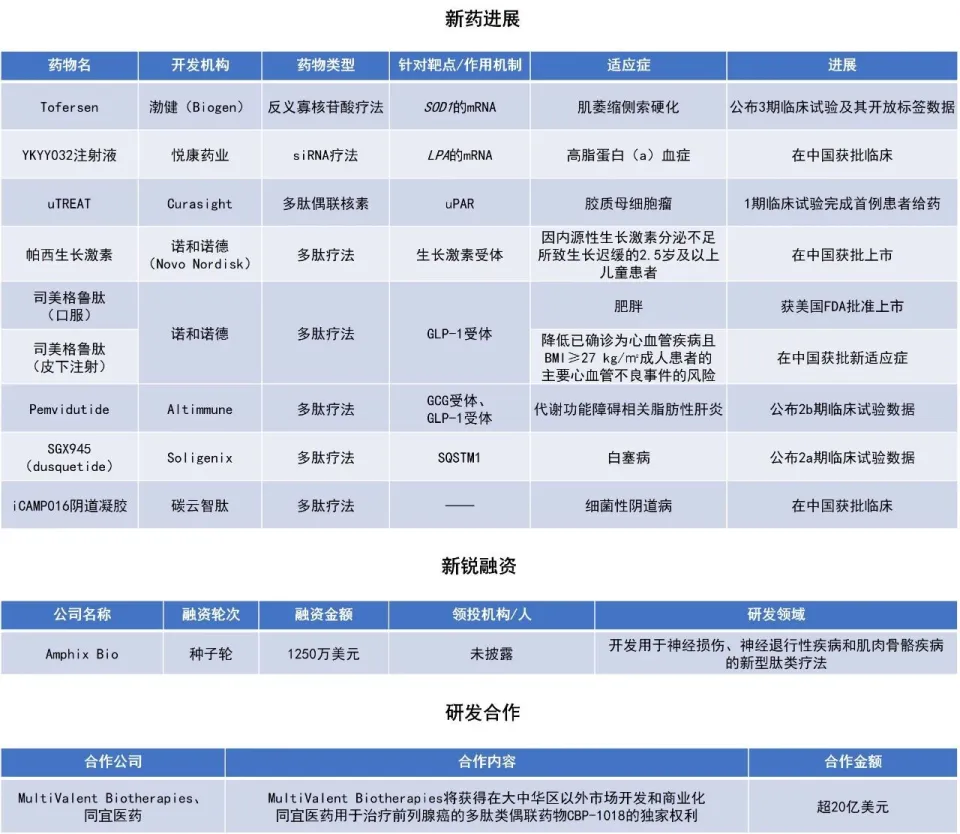
司美格鲁肽(口服):获美国FDA批准上市

诺和诺德宣布,美国FDA批准每日一次25 mg司美格鲁肽口服片剂(Wegovy),用于减少多余体重并长期维持体重下降,同时降低发生主要不良心血管事件的风险。诺和诺德同时也于2025年下半年向欧洲药品管理局(EMA)及其他监管机构提交了每日一次25 mg Wegovy口服片剂用于治疗肥胖症的监管申请。
此次批准主要基于OASIS试验项目和SELECT试验的积极结果。OASIS是一项3期临床开发项目,旨在评估每日一次口服25 mg和50 mg司美格鲁肽在肥胖症中的疗效。该全球3期临床项目共包括四项试验,纳入约1300名肥胖或超重并伴有一种或多种共病的成人受试者。
OASIS 4是一项为期64周的3b期疗效与安全性试验,旨在评估每日一次口服25 mg司美格鲁肽与安慰剂在307名肥胖或超重并伴有一种或多种共病的成人受试者中的疗效与安全性。在OASIS 4试验中,在治疗依从的情况下,每日一次口服25 mg司美格鲁肽在肥胖或超重并伴有一种或多种共病的成人受试者中实现了16.6%的平均体重下降。Wegovy口服片实现的减重效果与注射剂型2.4 mg Wegovy相当。此外,在OASIS 4试验中,约三分之一的受试者体重下降达到或超过20%。
在OASIS-4试验中,Wegovy口服片再次证实了司美格鲁肽良好的安全性和耐受性,其表现与此前相关试验结果一致。
司美格鲁肽(皮下注射):在中国获批新适应症

诺和诺德宣布,司美格鲁肽注射液(诺和盈)的心血管适应症上市申请获得NMPA批准,适用于降低已确诊为心血管疾病且身体质量指数(BMI)≥27 kg/㎡成人患者的主要心血管不良事件(MACE,包括心血管死亡、非致死性心肌梗死、非致死性卒中)的风险。此前,诺和盈已在中国获批适用于在控制饮食和增加体力活动的基础上对成人患者的长期体重管理。
此次心血管适应症的获批基于SELECT(司美格鲁肽在超重或肥胖患者中的心血管结局试验)的主要结果。该试验针对肥胖合并心血管疾病患者心血管结局,共纳入超过1.7万例超重或肥胖受试者。其主要结果显示,在标准治疗基础上,司美格鲁肽注射液相较于安慰剂实现了20%的MACE风险降低,降低心血管死亡风险15%,降低心衰复合终点风险18%,降低全因死亡风险19%。在长达五年的随访时间内,无论受试者基线年龄、性别、人种、种族、基线BMI和肾功能损害程度,均实现了MACE风险降低。
此外,针对SELECT研究数据的二次分析结果显示:在治疗早期,司美格鲁肽注射液就已显示出对心脏的保护作用,早于明显的体重减轻。这一发现提示,无论体重降幅,使用司美格鲁肽注射液均实现降低MACE风险的获益。
帕西生长激素:在中国获批上市

诺和诺德宣布,NMPA正式批准了其研发生产的长效生长激素注射液帕西生长激素(诺泽优)的上市申请,用于治疗因内源性生长激素分泌不足所致生长迟缓的2.5岁及以上儿童患者。该药通过脂肪酸衍生化技术实现蛋白药物与体内白蛋白的非共价可逆性结合,兼顾药代动力学和药效动力学,通过延长药物在体内分布的时间,从而延长半衰期,使其实现每周一次给药,减少年注射次数至52次,大幅降低患者治疗负担。新闻稿指出,帕西生长激素于2020年8月28日在美国批准用于治疗成人生长激素缺乏症(AGHD),并于2023年4月扩大了其适应症,成为全球首款获批用于儿童和成人生长激素缺乏症的生长激素周制剂。
帕西生长激素治疗儿童生长激素缺乏症(PGHD)的疗效已在全球3期临床试验REAL 4研究中得到了验证。在中国人群REAL6研究中,将110例未接受过治疗的患者,被随机分配至帕西生长激素(0.16 mg/kg/周)或该公司的重组人生长激素注射液日制剂(0.034 mg/kg/天)组,治疗52周。结果显示,帕西生长激素组的平均身高增长速度(HV)为11.0 cm/年,两组平均年化HV相当。同时,帕西生长激素耐受性良好,其安全性特征与日制剂的已知安全性特征一致,注射部位反应发生率较低(2.7%),52周治疗期间未报告注射部位疼痛,与日制剂相比,帕西生长激素的治疗负担更低。
同宜医药就前列腺癌多肽类偶联药物达成许可协议

同宜医药宣布与MultiValent Biotherapies公司就其多肽类偶联药物CBP-1018达成独家许可协议。CBP-1018是同宜医药基于其专有的Bi-XDC(双特异性双配体偶联药物)平台开发的一种针对前列腺癌的局部治疗(focal therapy)方案。CBP-1018是一种与Auristatin-E偶联的双特异性多肽药物,靶向前列腺癌细胞中高表达的两种蛋白:PSMA和FRα。
临床前研究显示,局部给药CBP-1018可显著增加前列腺组织中的药物暴露量,同时降低全身药物暴露量和毒性。在针对110多名转移性去势抵抗性前列腺癌患者的1/2期临床试验中,静脉注射CBP-1018展现出了令人鼓舞的初步安全性和有效性。在所有剂量组中,CBP-1018达到了8.5个月的中位无进展生存期(mPFS)。
根据协议条款,MultiValent将获得在大中华区以外市场开发和商业化CBP-1018的独家权利。作为回报,同宜医药将获得2000万美元的首付款以及MultiValent公司20%的股权。此外,同宜医药还拥有未来累计可高达约20亿美元的开发、药政监管及商业里程碑付款。
参考资料:
Novo Nordisk A/S: Wegovy® pill approved in the US as first oral GLP-1 for weight management. Retrieved December 26, 2025, from https://www.globenewswire.com/news-release/2025/12/22/3209605/0/en/Novo-Nordisk-A-S-Wegovy-pill-approved-in-the-US-as-first-oral-GLP-1-for-weight-management.html
中国国家药监局药品审评中心(CDE)官网. Retrieved December 26, 2025, from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
中国首个且目前唯一!长期体重管理药物诺和盈®获批心血管适应症. Retrieved December 26, 2025, from https://mp.weixin.qq.com/s/qZ98RPmYpPR4jvs5cFWc2A
超20亿美元!同宜医药全球首款Bi-XDC药物出海,探索前列腺癌治疗新边界. Retrieved December 26, 2025, from https://mp.weixin.qq.com/s/9HoyaQNIsOLB-Lxt0OZhJA
Amphix Bio raises $12.5M seed round to advance peptide drug platform. Retrieved December 26, 2025, from https://www.prnewswire.com/news-releases/amphix-bio-raises-12-5m-seed-round-to-advance-peptide-drug-platform-302646037.html
The Journal of the American Medical Association (JAMA) Neurology Publishes Long Term Results from the QALSODY Phase 3 VALOR Study and its Open-Label Extension in SOD1-ALS. Retrieved December 26, 2025, from https://www.globenewswire.com/news-release/2025/12/22/3209411/0/en/The-Journal-of-the-American-Medical-Association-JAMA-Neurology-Publishes-Long-Term-Results-from-the-QALSODY-Phase-3-VALOR-Study-and-its-Open-Label-Extension-in-SOD1-ALS.html
Positive Clinical Results from Phase 2 Trial of SGX945 for the Treatment of Behçet's Disease Published in Rheumatology (Oxford). Retrieved December 26, 2025, from https://www.prnewswire.com/news-releases/positive-clinical-results-from-phase-2-trial-of-sgx945-for-the-treatment-of-behcets-disease-published-in-rheumatology-oxford-302645452.html
诺和诺德长效生长激素诺泽优®(帕西生长激素)正式在华获批,为中国患儿带来更”优”选择. Retrieved December 26, 2025, from https://www.prnasia.com/story/517292-1.shtml
Curasight Announces Successful Dosing of First Patient in Phase 1 trial with uTREAT® in Brain Cancer. Retrieved December 26, 2025, from https://www.prnewswire.com/news-releases/curasight-announces-successful-dosing-of-first-patient-in-phase-1-trial-with-utreat-in-brain-cancer-302646271.html
Altimmune Announces that Pemvidutide Achieved Key Measures of Success at 48 Weeks in IMPACT Phase 2b MASH Trial. Retrieved December 26, 2025, from https://www.globenewswire.com/news-release/2025/12/19/3208385/0/en/Altimmune-Announces-that-Pemvidutide-Achieved-Key-Measures-of-Success-at-48-Weeks-in-IMPACT-Phase-2b-MASH-Trial.html